Thyroïdectomie
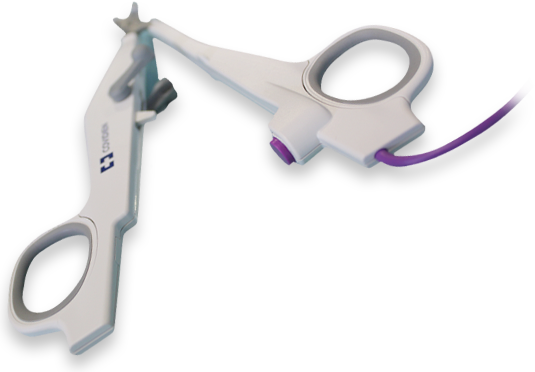
Application pratique du système LigaSure™ Small Jaw Instrument
Résumé du module de formation
Ce module d'e-learning en ligne a pour objectif la présentation d'un instrument, source d'énergie bipolaire avancée, le système LigaSure™ Small Jaw Instrument, lors de son utilisation au cours d'une thyroïdectomie réalisée pour traitement de pathologie thyroïdienne.
Ce module en ligne de 25 minutes analysera les principes fondamentaux de l'énergie bipolaire avancée, les techniques chirurgicales et les recommandations associées pour une utilisation sûre et efficace de cet instrument ainsi que l'état de l'art de la recherche fondée sur les faisceaux de preuve relative à l'utilisation du système LigaSure™ Small Jaw Instrument en termes de durée opératoire, de perte de sang et de durée d'hospitalisation pour le patient qui subit une thyroïdectomie.
Objectifs du module de formation
- Connaître et maîtriser les données cliniques issues de publications en série au sujet de l'utilisation de sources d'énergie avancées dans une thyroïdectomie.
- Savoir comment identifier et résoudre les problèmes standards rencontrés lors de l'utilisation de sources d'énergie avancées dans une thyroïdectomie.
- Savoir comment réduire les complications postopératoires fréquentes.
- Maîtriser les recommandations techniques en matière de sources d'énergie avancées utilisées au cours d'une thyroïdectomie.


Sources D'énergie
Advanced Energy
- Butskiy O, Wiseman SM. Electrothermal bipolar vessel sealing system (LigaSure) for hemostasis during thyroid surgery: a comprehensive review. Expert Rev Med Devices 2013;10:389-410. PubMed
- Parmeggiani D, De Falco M, Avenia N, Sanguinetti A, Fiore A, Docimo G, Ambrosino P, Madonna I, Peltrini R, Parmeggiani U. Nerve sparing sutureless total thyroidectomy. Preliminary study Ann Ital Chir. 2012 ;83:91-6. PubMed
- Dionigi G, Boni L, Rausei S, Frattini F, Ferrari CC, Mangano A, Leotta A, Franchin M. The safety of energy-based devices in open thyroidectomy: a prospective, randomised study comparing the LigaSure (LF1212) and the Harmonic® FOCUS. Langenbecks Arch Surg. 2012;397:817-23. PubMed
- Rahbari R, Mathur A, Kitano M, Guerrero M, Shen WT, Duh QY, Clark OH, Kebebew E. Prospective randomized trial of ligasure versus harmonic hemostasis technique in thyroidectomy. Ann Surg Oncol. 2011;18:1023-7. PubMed
- Saint Marc O, Cogliandolo A, Piquard A, Famà F, Pidoto RR. LigaSure vs clamp-and-tie technique to achieve hemostasis in total thyroidectomy for benign multinodular goiter: a prospective randomized study. Arch Surg. 2007 Feb;142:150-6. PubMed
Strasbourg (FRANCE)
Professeur de
Chirurgie Digestive et Endocrinienne
Hôpitaux
Universitaires de Strasbourg, France

Technique Opératoire

The description of the minimally invasive video-assisted thyroidectomy covers all aspects of the surgical procedure used for the management of thyroid nodules.
Operating room set up, position of patient and equipment, instruments used are thoroughly described. The technical key steps of the surgical procedure are presented in a step by step way: dissection, ligatures, extraction/resection.
Consequently, this operating technique is well standardized for the management of this condition.
Strasbourg (FRANCE)
Chirurgien de
spécialité digestive et endocrinienne
Hôpitaux Universitaires de Strasbourg,
France

- 1. IntroductionLa première parathyroïdectomie endoscopique a été réalisée par Gagner en 1996 (Gagner, 1996). Depuis cette date, des techniques vidéo-assistées ont été appliquées à la chirurgie de la région cervicale. Plusieurs séries (Miccoli et al., 2000; Henry et al., 1999) ont documenté la faisabilité des approches vidéo-assistées dans le traitement des maladies des glandes thyroïdes et parathyroïdes.
Les premières interventions endoscopiques réalisées dans le cadre de petits nodules thyroïdiens ont été introduites en 1998 (Miccoli et al., 2001a; Ohgami et al., 2000; Shimizu et al., 1999). Ces interventions ne se sont pas répandues ; en effet, les avantages de ce type de chirurgie mini-invasive sont moins évidents qu’en chirurgie abdominale. Il n’en est que plus vrai pour la thyroïdectomie, car l’intervention par voie ouverte est bien codifiée. L’inconvénient principal de ces interventions mini-invasives tient au fait qu’un nombre restreint de patients peut en bénéficier, en particulier dans les régions du monde où le goitre sévit de manière endémique. En outre, les temps opératoires et les taux de complications sont supposés être plus élevés en début d’expérience, comme pour chaque nouvelle chirurgie mini-invasive. Les coûts et les inégalités devant les nouvelles technologies peuvent également être des éléments dissuasifs à l’utilisation de ces techniques.
La chirurgie thyroïdienne est largement répandue. Ce chapitre décrit une technique classique parfaitement standardisée permettant un risque récurrentiel et parathyroïdien minimum. Cette technique est sûre, reproductible dans la majorité des cas. Elle a été adaptée de la technique chirurgicale apprise au côté de Charles Proye. L’utilisation de moyens d’hémostases modernes diminue le temps opératoire sans augmenter les risques.
Cette technique est utilisable pour tous les types de lésions thyroïdiennes bénignes ou malignes. - 2. Anatomie
- • Embryologie1. Première poche pharyngée
2. Deuxième poche pharyngée
3. Cordon épithélial
4. Glande thyroïde
La glande thyroïde commence à se former entre la première et la deuxième poche pharyngienne aux environs du 17è jour de l’embryogenèse. Le corps thyroïde forme rapidement un cordon épithélial qui s’enfonce dans le plancher de l'intestin pharyngien. Il atteint la face antérieure de la trachée et perd sa connexion avec le plancher de l'intestin pharyngien. C’est à cette étape que la tête du canal bifurque et se déploie transversalement pour former 2 lobes latéraux. Dans certains cas, il arrive que le canal subsiste partiellement sous la forme d’un kyste du tractus thyréoglosse. - • Anatomie chirurgicale1. Lobe droit
2. Lobe gauche
3. Isthme
4. Lobe pyramidal
5. Capsule
6. Ligament de Berry
7. Muscle sternothyroïdien
8. Muscle sternohyoïdien
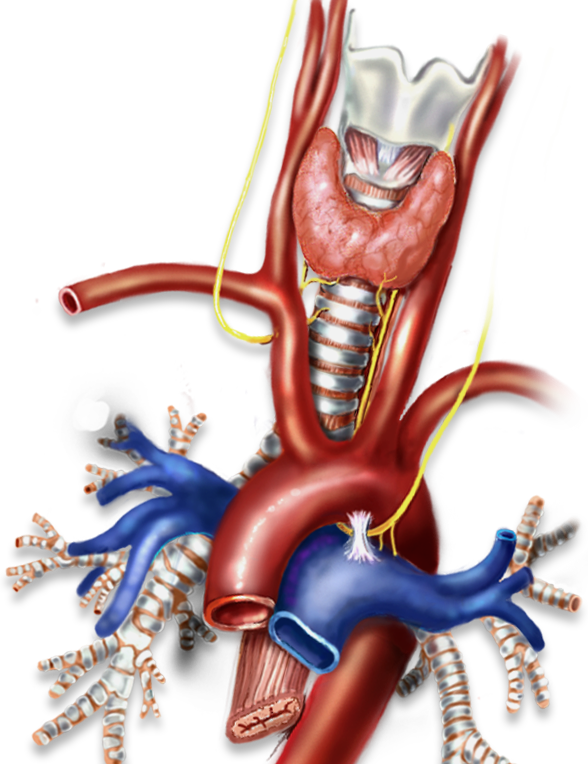
La glande thyroïde est formée de 2 lobes réunis par un isthme. La glande pèse environ 20 g chez l’adulte. Chaque lobe revêt une forme conique et mesure environ 2 x 3 x 5 cm. La glande thyroïde est généralement de couleur rouge foncée, souple et recouverte par une fine capsule.
La glande est disposée dans la région cervicale inférieure, là où l’isthme traverse la trachée au niveau des 2è et 3è anneaux. Le ligament suspenseur supérieur (ligament de Gruber) fixe la glande à cette structure.
La glande est recouverte par les muscles sterno-hyoïdiens et sterno-thyroïdiens. Elle est reliée au niveau de la ligne médiane par la ligne blanche cervicale (aponévrose cervicale antérieure). La partie interne de chaque lobe repose sur le larynx et la trachée. L’œsophage est situé en arrière et légèrement décalé vers la gauche par rapport au lobe thyroïdien. Le parcours du nerf laryngé récurrent suit plus ou moins verticalement le trajet de la gouttière trachéo-oesophagienne. Les pôles supérieurs sont en contact avec le muscle constricteur inférieur du pharynx et la face postérieure du muscle crico-thyroïdien. Le pôle inférieur se prolonge généralement jusqu’au 4è ou 5è anneau trachéal. Il arrive fréquemment qu’un résidu du canal thyréoglosse se prolonge vers le haut à partir de l’isthme thyroïdien et se développe de manière variable (pyramide de Lalouette). - • Vascularisation1. Artère carotidienne externe
2. Artère thyroïdienne supérieure
3. Nerf laryngé supérieur
4. Artère thyroïdienne inférieure
5. Tronc thyrocervical
6. Nerf laryngé inférieur
7. Glande parathyroïdienne inférieure
8. Glande parathyroïdienne supérieure
9. Veine thyroïdienne supérieure
10. Veine thyroïdienne moyenne
11. Veine thyroïdienne inférieure
La glande est vascularisée par les artères thyroïdiennes inférieure et supérieure. L’artère thyroïdienne supérieure est issue de la carotide externe. Elle descend le long de la surface du muscle constricteur inférieur du pharynx et pénètre dans le pôle supérieur de la thyroïde sur sa face antéro-supérieure. Dans environ 10 % des cas, une branche de cette artère irrigue la glande parathyroïde supérieure. Le trajet de la branche externe du nerf laryngé supérieur suit de très près les branches de l’artère thyroïdienne supérieure, même si ce rapport est assez variable.
L’artère thyroïdienne inférieure est une branche du tronc thyro-cervical (tronc thyro-bicervico-scapulaire). Dans sa partie supérieure, elle passe en arrière de l’artère carotide commune et de la veine jugulaire et se dirige vers le cartilage cricoïde. Elle se divise en plusieurs branches terminales. Cette artère et ses branches sont en rapport très étroit avec le nerf laryngé inférieur récurrent. Une branche de l’artère thyroïdienne inférieure irrigue généralement la glande parathyroïde inférieure. Dans la plupart des cas, l’artère thyroïdienne inférieure irrigue également la glande parathyroïde supérieure. L’artère thyroïdienne moyenne est inconstante : elle est issue du tronc artériel brachio-céphalique et se jette dans l’isthme thyroïdien.
Le drainage veineux est plus variable que la vascularisation artérielle. La veine thyroïdienne supérieure est en rapport intime avec l’artère thyroïdienne supérieure. Elle se jette dans la veine jugulaire interne. Les veines thyroïdiennes moyennes varient en nombre. Elles vont du bord externe du lobe et se jettent dans la veine jugulaire interne. Les veines inférieures ont un trajet distinct des artères thyroïdiennes inférieures. Elles drainent les lobes inférieurs et se jettent dans la veine jugulaire interne ou dans les troncs veineux brachio-céphaliques. - • Drainage lymphatique1. Compartiment central
2. Compartiment latéral
3. Veine innominée
4. Trachée
5. Carotide
Le drainage lymphatique de la glande thyroïde est très vaste. Le chirurgien doit prendre en compte deux principales zones de drainage lymphatique : un compartiment central (espace périglandulaire) et un compartiment latéral. La gaine carotidienne sépare les deux compartiments.
Le compartiment central comprend les groupes des ganglions prélaryngés, prétrachéaux, paratrachéaux-oesophagiens. Les muscles sterno-hyoïdiens et sterno-thyroïdiens constituent la limite antérieure de ce compartiment. Il existe une connexion importante entre les deux compartiments et les deux côtés en raison de l’existence d’un réseau capsulaire qui est en communication avec les vaisseaux lymphatiques profonds. Le compartiment central est délimité par la veine innominée vers le bas, la trachée au milieu et par la carotide sur le côté. - • Nerfs laryngés
- • Nerf laryngé supérieur1. Nerf laryngé supérieur
2. Pôle thyroïdien supérieur
3. Muscle constricteur moyen
4. Branche externe du nerf laryngé supérieur
5. Branche interne du nerf laryngé supérieur
6. Muscle cricothyroïdien
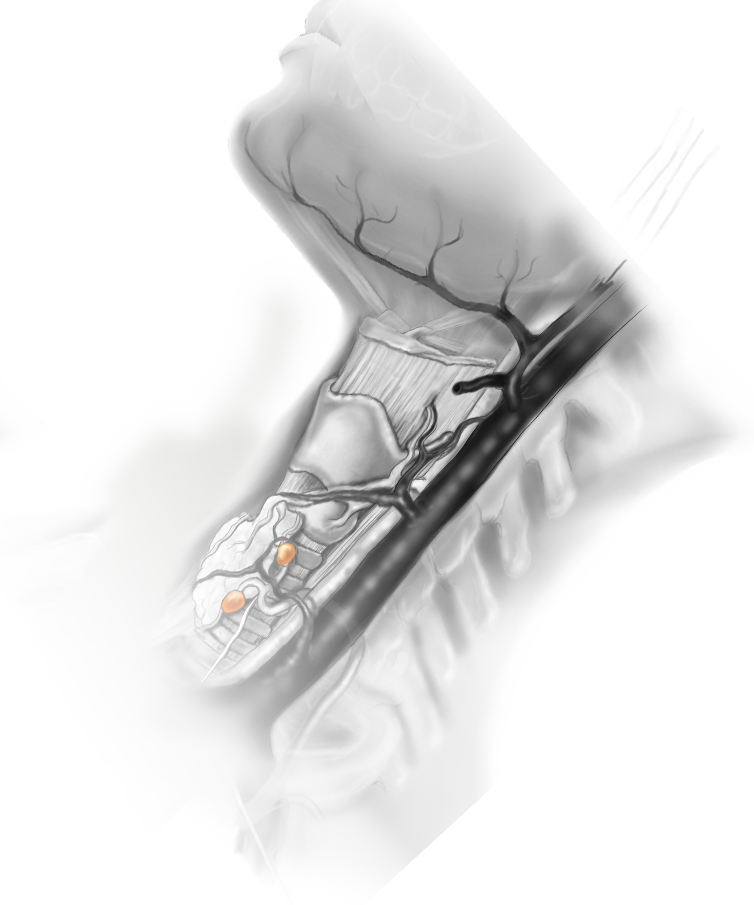
La branche externe du nerf laryngé supérieur est en contact étroit avec les vaisseaux thyroïdiens supérieurs et le pôle thyroïdien supérieur. Le nerf laryngé supérieur est issu du nerf vague (pneumogastrique) et se dirige vers le bas au contact des muscles constricteurs moyens du pharynx. À ce niveau, le nerf laryngé supérieur se divise en branches externe et interne. Sa branche externe se dirige vers le bas et innerve le muscle crico-thyroïdien, muscle tenseur des cordes vocales ; des lésions de la branche laryngée externe peuvent ainsi être responsables de troubles de la phonation, en particulier de difficultés à émettre des sons aigus.
Dans 6 % à 18 % des cas (Berti et al., 2002), la branche externe du nerf laryngé supérieur chemine soit avec ou autour de l’artère thyroïdienne supérieure ou de ses branches et est sujette à lésion au cours de la dissection. Dans environ 20 % des cas (Berti et al., 2002), elle n’est pas située dans le champ opératoire autour du pôle supérieur de la glande thyroïde et ne peut pas être visualisée en chirurgie conventionnelle. Grâce à l’endoscope, le grossissement des structures et un angle de vision à 30° contribuent à exposer la totalité de la face antérieure du muscle crico-thyroïdien. Ainsi sa préparation est facilitée lors d’interventions vidéo-assistées. Au cas où le nerf a un trajet qui ne permet pas de le visualiser, l’artère thyroïdienne supérieure doit être liée sélectivement et à proximité de la capsule thyroïdienne. - • Nerf laryngé inférieur1. Nerf laryngé inférieur
2. Nerf vague
3. Artère sous-clavière droite
4. Arche aortique
Le nerf laryngé inférieur récurrent est issu du nerf vague. Il innerve tous les muscles du larynx, à l’exception du muscle crico-thyroïdien. À droite, le nerf passe autour de l’artère sous-clavière. À gauche, le nerf passe autour de la crosse de l’aorte. Les deux nerfs cheminent vers le haut et en dedans, en direction du cartilage cricoïde là où il pénètre le larynx. Le nerf laryngé inférieur n’est pas formé d’un seul faisceau de fibres ; il se divise en plusieurs branches. Il donne une branche à l’œsophage, à la trachée et à la glande thyroïde. Il s’anastomose avec d’autres structures nerveuses (nerf laryngé supérieur, système sympathique, nerf controlatéral). Le rapport entre l’artère thyroïdienne inférieure et le nerf laryngé inférieur est très variable. Ce dernier peut passer au devant, en arrière ou entre les branches de l’artère. Dans moins de 1 % des cas (Henry et al., 1988), le nerf n’est pas récurrent à droite ; il est issu directement du nerf vague sur le cou, rejoignant le larynx en suivant un trajet plus ou moins transversal. Cette variation est causée par une anomalie vasculaire qui se forme lors de l’embryogenèse et qui est à l’origine d’une artère sous-clavière aberrante (arteria lusoria ou artère sous-clavière droite rétro-oesophagienne), issue directement de la crosse de l’aorte à gauche de l’artère sous-clavière gauche et passant directement en position transversale en arrière de l’œsophage. Cette anomalie est exceptionnelle à gauche. Elle survient dans des cas de situs inversus et d’anomalie vasculaire associée. - 3. Indications et contre-indicationsLa thyroïdectomie par voie classique reste la technique de référence pour traiter des pathologies thyroïdiennes bénignes ou malignes. Les techniques mini-invasives permettent de prendre en charge des pathologies bien ciblées et ne peuvent pas être utilisées dans tous les cas.
- 4. Prise en charge préopératoirePrincipaux pré-requis
Tests sanguins : ils permettront de vérifier le taux des hormones thyroïdiennes et de suspecter une éventuelle thyroïdite.
Échographie : elle précisera le volume de la glande et détectera la présence éventuelle de ganglions suspects
Ponction-biopsie à l’aiguille : pour évaluer la nature du nodule (bénin, malin, suspect).
- 5. Bloc opératoire
- • Patient- décubitus dorsal, cou en hyperextension ;
- préparation cervicale conventionnelle et pose de champs ;
- champ stérile recouvrant la peau. - • Equipe1. Le chirurgien se place à droite du patient.
2. Le premier assistant se place en face du chirurgien.
3. Le second assistant se place à la droite du chirurgien.
4. L’instrumentiste se place à gauche du premier assistant en face du chirurgien.
- • Equipement1. Table d'opération
2. Equipement d'anesthésie
3. Générateur de bistouri électrique
4. Système LigaSure™ Precise Small Jaw
Aucun générateur à ultrasons n'est requis. - 6. Instrumentation1. Deux pincettes à griffes
2. Deux pincettes sans griffes
3. Une pincette à hémostase
4. Un manche de bistouri électrique
5. Un système LigaSure™ Precise Small Jaw
6. Une pince à angle droit
7. Une paire de ciseaux
8. Un applicateur de clips
9. Fils pour suspension du lambeau
10. Quatre écarteurs de Farabeuf
11. Deux écarteurs de Langenbeck
12. Deux pinces de traction atraumatique
13. Un porte aiguille
14. Une pince de Kelly
- 7. Dissection de la glande thyroïdienne
- • Préparation cervicale
- • Incision cutanéeUne incision adaptée à la taille de la lésion est réalisée 2 cm au-dessus de la fourchette sternale. Le tissu sous-cutané est incisé.
- • Dissection du tissu sous-cutané
- • Suspension du lambeau cutanéUn lambeau sous-cutané supérieur est disséqué au bistouri électrique. Ce lambeau est mis en traction permettant ainsi une exposition de la région cervicale.
- • Incision de la gouttière jugulo-carotidienne
- • Dissection du muscle SCMLe bord interne du muscle sterno-cléïdo mastoïdien est disséqué pour découvrir la face antérieure de la veine jugulaire.
- • Dissection du muscle omo-hyoïdienLe bord interne du muscle omo-hyoïdien est disséqué.
- • Section de la veine moyenne
- 8. Lobe droit
- • Repérage de l'artère thyroïdienne inférieure et du nerf récurrentL’espace entre le paquet jugulo-carotidien et la thyroïde est disséqué. Les écarteurs placés d’une part sur la carotide, sur la glande thyroïdienne permettent de découvrir l’artère thyroïdienne inférieure et de rechercher le nerf récurrent.
- • Section des muscles préthyroïdiensLorque ces 2 éléments ont été identifiés, on réalise une section des muscles préthyroïdiens avec le LigaSure™ Precise Small Jaw.
- • Dissection polaire supérieure
- • Dissection du pôle supérieurOn aborde ensuite le pôle supérieur. Les faces antérieures et latérales de la glande thyroïde sont disséquées pour les séparer des muscles préthyroïdiens.
- • Section des vaisseaux polaires supérieursLes vaisseaux du pôle supérieurs sont disséqués et sectionnés.
- • Dissection du pôle supérieur droitLe nerf laryngé supérieur est répéré et préservé. Les vaisseaux supérieurs sont sectionnés à l’aide du LigaSure™ Precise Small Jaw.
- • Dissection du pôle inférieur de la glandeOn aborde ensuite le pôle inférieur. Les vaisseaux sont disséqués, puis sectionnés.
- • Dissection de la parathyroïde
- • Dissection de la glande parathyroïdienne inférieureLa thyroïde peut dès lors être rétractée pour exposer sa face latérale.
Les parathyroïdes sont recherchées et abaissées. La glande parathyroïde inférieure sera recherchée en avant de l’intersection artério-nerveuse. Si elle n’est pas retrouvée en position orthotopique, elle sera recherchée à la partie supérieure et postérieure de la coulée thyro-thymique. - • Dissection de la glande parathyroïdienne supérieureLa parathyroïde supérieure est retrouvée à l’impact de la branche la plus crânienne de l’artère thyroïdienne supérieure.
- • Fin de dissection de la glande
- • Abaissement du nerf laryngé
- • Libération du lobe droit
- 9. Lobe gauche
- • Dissection polaire supérieure
- • Dissection vasculonerveuse
- • Libération du pôle supérieur
- • Dissection latérale
- • Dissection de l'artère thyroïdienne inférieure et du nerf récurrent
- • Dissection du nerf récurrentLe nerf récurrent est alors disséqué pour l’abaisser.
Le lobe peut être séparé du lobe controlatéral grâce au LigaSure™ Precise Small Jaw. En cas de thyroïdectomie totale, les mêmes étapes sont répétées dans le même ordre. - 10. Résection de la glande thyroïdienne et fermeture cutanée
- • Fin de la dissection
- • Drainage et fermeture du lambeau
- 11. ConclusionCette technique opératoire est classique. Elle peut être utilisée pour toute pathologie thyroïdienne. Les différentes règles de curage ganglionnaire en cas de cancer ne sont pas décrites.
A l'identique, en cas de goitres volumineux ou plongeants, cette technique devra être adaptée en fonction du volume et de la position du goitre. - 12. RéférencesBertt P. Materazzi G, Conte M, Galleri D, Miccoli P. Visualization of the external branch of the superior laryngeal nerve during video-assisted thyroidectomy. J Am Coll Surg 2002; 195:573-4. pubmed
Dralle H, Damm l, Scheumann GF, Kotzerke J, Kupsch E, Geerlings H et al. Compartment-oriented microdissection of regional lymph nodes in medullary thyroid carcinoma. Surg Today 1994:24:112-21. pubmed
Gagner M. Endoscopic subtotal parathyroidectomy in patients with primary hyperparathyroidism. Br J Surg 1996,83:875. pubmed
Henry JF, Audiffret J, Denizot A, Plan M. The nonrecurrent inferior laryngeal nerve: review of 33 cases, including two on the left side. Surgery 1988,104:977-84. pubmed
Henry JF, DeTechereux T, Gramatica L, de Boissezon C. Minimally invasive videoscopic parathyroidectomy by latéral approach. LangenbecksArch Surg 1999:384:298-301. pubmed
Miccoli P, Berti P, Raffaelli M, Conte M, Materazzi G, Galleri D. Minimally invasive video-assisted thyroidectomy. Am J Surg 2001 a; 181:567-70. pubmed
Miccoli P. Berti P, Raffaelli M, Materazzi G, Baldacci S, Rossi G. Comparison between minimally invasive video-assisted thyroidectomy and conventional thyroidectomy: a prospective randomized study. Surgery 2001b;130:1039-43. pubmed
Miccoli P. Bellantone R, Mourad M, Walz M, Raffaelli M, Berti P. Minimally Invasive Video-assisted Thyroidectomy: Multiinstitutional Experience. World J Surg 2002a;26:972-5. pubmed
Miccoli P. Elisei R, Materazzi G, Capezzone M, Galleri D, Pacini F et at. Minimally invasive video-assisted thyroidectomy for papillary carcinoma: a prospective study about its œmpleteness. Surgery, 2002b;132:1070-3; discussion 1073-4. pubmed
Miccoli P. Berti P, Conte M, Raffaelli M, Materazzi G'' Minimally invasive video-assisted parathyroidectomy: lesson learned from 137 cases. J Am Coll Surg 2000:191:613-8. pubmed
Ohgami M, Ishii S, Arisawa Y, Ohmori T, Noga K, Furukawa T et a/ Scariess endoscopic thyroidectomy: breis't approach for better cosmesis. Surg Laparosc Endosc Percutan Tech 2000; 10:1-4. pubmed
Shimizu K, Akira S, Jasmi AY, Kitamura Y, Kitagawa W, Akasu H et al. Video-assisted neck surgery: endoscopic resection of thyroid tumors with a very minimal neck wound. J Am Coll Surg 1999:188:697-703. pubmed
Avis D'experts
- Lepner U, Vaasnat T. Ligasure vessel sealing system versus conventional vessel ligation in thyroidectomy. Scand Journal Surg 2007:96;31-4. PubMed
- Covidien. Internal document. DSCHOW 7-5-12.
- Kim FJ, Chammas MF, Gewehr E, Morihisa M, Caldas F, Hayacibara E, Baptistussi M, Meyer F, Martins AC. Temperature safety profile of laparoscopic devices: Harmonic ACE (ACE), Ligature V (LV), and plasma trisector (PT). Surg Endosc 2008:22:1464-9. PubMed
- Scilletta B, Cavallaro MP, Ferlito F, Li Destri G, Minutolo V, Frezza EE, Di Cataldo A. Thyroid surgery without cut and tie: the use of Ligasure for total thyroidectomy. Int Surg 2010;95:293-8. PubMed
- Miccoli P, Davis T. Thyroid Surgery: Preventing and Managing Complications. Wiley-Blackwell Oxford 2013. Google Books
Professeur de
Chirurgie
Università degli Studi di Pisa, Pise,
Italie

Strasbourg (FRANCE)
Consultante en chirurgie digestive, chirurgienne des voies
digestives hautes
Hôpitaux Universitaires de Strasbourg,
France


Opération Chirurgicale
Parathyroidectomy
Strasbourg (FRANCE)
Professeur en chirurgie
Hôpitaux Universitaires de Strasbourg, France

Strasbourg (FRANCE)
Chirurgien de
spécialité digestive et endocrinienne
Hôpitaux Universitaires de Strasbourg,
France


Experts

Professeur de
Chirurgie
Università degli Studi di Pisa, Pise,
Italie

Consultante en chirurgie digestive, chirurgienne des voies
digestives hautes
Hôpitaux Universitaires de Strasbourg,
France

Professeur en chirurgie
Hôpitaux Universitaires de Strasbourg, France

Chirurgien de
spécialité digestive et endocrinienne
Hôpitaux Universitaires de Strasbourg,
France

Professeur de
Chirurgie Digestive et Endocrinienne
Hôpitaux
Universitaires de Strasbourg, France
Médiathèque
Videos
Photos
References
2. Franko J, Kish KJ, Pezzi CM, Pak H, Kukora JS. Safely increasing the efficiency of thyroidectomy using a new bipolar electrosealing device (LigaSure) versus conventional clamp-and-tie technique. Am Surg. 2006 Feb;72(2):132-6. PubMed
3. Fujita T, Doihara H, Ogasawara Y, Shimizu N. Utility of vessel-sealing systems in thyroid surgery. Acta Med Okayama. 2006 Apr;60(2):93-8. PubMed
4. Kirdak T, Korun N, Ozguc H. Use of ligasure in thyroidectomy procedures: Results of a prospective comparative study. World J Surg. 2005 Jun;29(6):771-4. PubMed
5. Lepner U, Vaasna T. Ligasure vessel sealing system versus conventional vessel ligation in thyroidectomy. Scand J Surg. 2007;96(1):31-4. PubMed

 Français ▼
Français ▼ English
English Deutsch
Deutsch Italiano
Italiano Español
Español Portuguese
Portuguese 简体中文
简体中文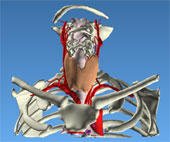
 Sources d'énergie
Sources d'énergie Avis d'experts
Avis d'experts Opération chirurgicale
Opération chirurgicale Clinical Experience Using Multifunctional LigaSure™ Small Jaw
Clinical Experience Using Multifunctional LigaSure™ Small Jaw LigaSure™ Small Jaws Instrument
LigaSure™ Small Jaws Instrument LigaSure™ Small Jaws brochure
LigaSure™ Small Jaws brochure Self-study guide Electrosurgery
Self-study guide Electrosurgery